根据《医疗器械监督管理条例》(国务院令第680号)的规定,对医疗器械按照风险程度实行分类管理。
第Ⅰ类是风险程度低,实行常规管理可以**其安全、有效的医疗器械,境内生产企业需要在所在地市药监局进行备案,境外医疗器械生产企业需要委托境内代理人在NMPA进行备案。
第Ⅲ类是具有较高风险,需要采取特别措施严格控制管理以**其安全、有效的医疗器械,无论境内、境外医疗器械生产企业均需要在NMPA进行注册。

根据《医疗器械监督管理条例》(国务院令第680号)的规定,对医疗器械按照风险程度实行分类管理。
第Ⅰ类是风险程度低,实行常规管理可以**其安全、有效的医疗器械,境内生产企业需要在所在地市药监局进行备案,境外医疗器械生产企业需要委托境内代理人在NMPA进行备案。
第Ⅲ类是具有较高风险,需要采取特别措施严格控制管理以**其安全、有效的医疗器械,无论境内、境外医疗器械生产企业均需要在NMPA进行注册。
文件名称 | 文号 |
《医疗器械监督管理条例》 | 国务院令第680号 |
《医疗器械注册管理办法》 | 国家食品药品监督管理总局令第4号 |
《医疗器械说明书和标签管理规定》 | 国家食品药品监督管理总局令第6号 |
《医疗器械临床试验质量管理规范》 | 国家食品药品监督管理总局令第25号 |
《医疗器械生产监督管理办法》 | 国家食品药品监督管理总局局令第37号 |
《医疗器械经营监督管理办法》 | 国家食品药品监督管理总局局令第37号 |
《医疗器械分类规则》 | 国家食品药品监督管理总局令第15号 |
《医疗器械临床试验质量管理规范》 | 国家食品药品监督管理总局令第25号 |
预算、合同、考虑期,1个月。
考虑检测平均消耗6个月,视产品情况有所变化,如无强标更新,则可免除检测。
如需精算请联络亿麦思。(免临床目录产品除外。)
注册资料编制可与检测并行。
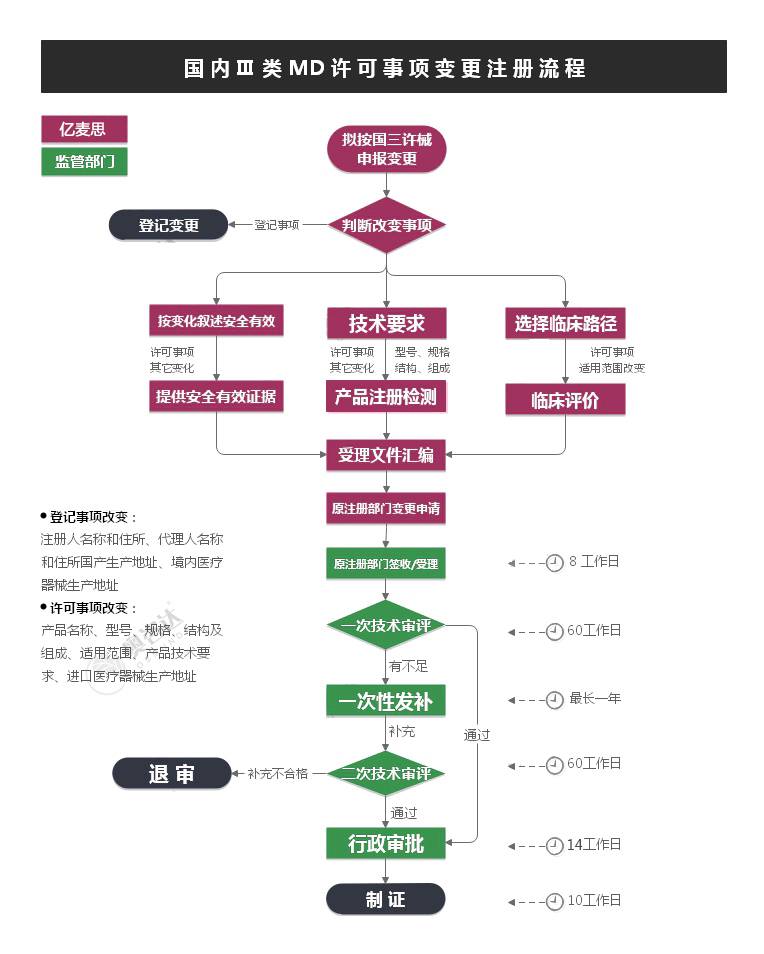
NMPA法定消耗预算8个月。(158工日,20工日/月,不计节假,与首次注册一致。)
发补时限0~12个月,考虑平均时间6个月。视产品首次申报资料情况而定。
进口Ⅱ类MD许可事项变更注册,预算应至少15~21个月以上。
NMPA II、III类医疗器械注册咨询;
NMPA 体外诊断试剂注册咨询;
NMPA 进口I、II、III类医疗器械注册咨询;
NMPA I类医疗器械备案办理咨询;
医疗器械优先审批办理咨询
创新医疗器械审批申请服务
欧盟CE(MDD、IVDD、PPE、AIMDD);
美国FDA(列名、510K、PMA);
全球注册(加拿大、澳大利亚、日本等)
体系建立\内审\运行\考核服务;
医疗器械临床试验服务;
注册、体系、临床培训服务;