国家食品药品监督管理部门对同时符合下列情形的医疗器械优先进行技术审评审批:
(一)申请人经过其技术创新活动,在中国依法拥有产品核心技术发明专利权,或者依法通过受让取得在中国发明专利权或其使用权;或者核心技术发明专利的申请已由国务院专利行政部门公开。
(二)产品主要工作原理/作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并且具有显著的临床应用价值。
(三)申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。

国家食品药品监督管理部门对同时符合下列情形的医疗器械优先进行技术审评审批:
(一)申请人经过其技术创新活动,在中国依法拥有产品核心技术发明专利权,或者依法通过受让取得在中国发明专利权或其使用权;或者核心技术发明专利的申请已由国务院专利行政部门公开。
(二)产品主要工作原理/作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并且具有显著的临床应用价值。
(三)申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
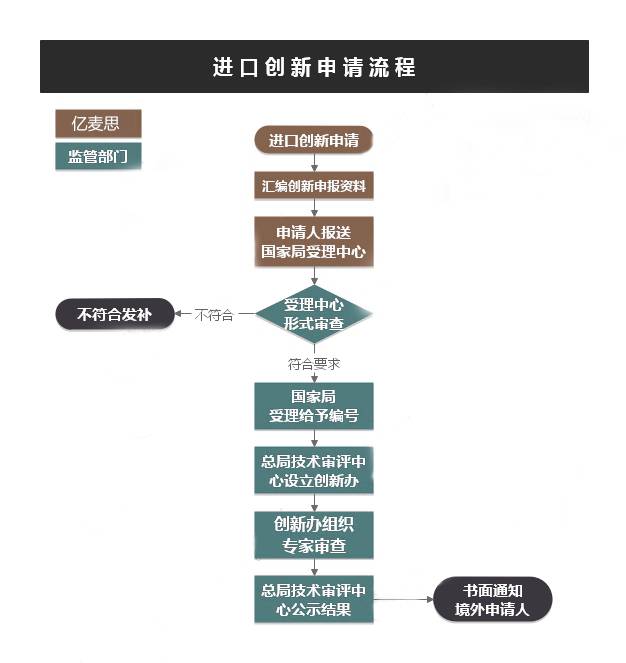
创新申请NMPA不收费。批准或未批准创新批件,不影响III类\II类产品首次注册收费。小微企业创新产品首次注册依法享受收费减免。
国务院令第680号《医疗器械监督管理条例》
国家食品药品监督管理局“食品药品监管总局关于印发创新医疗器械特别审批程序(试行)的通知” 食药监械管〔2014〕 13号
理论时间 60(工作日)
NMPA II、III类医疗器械注册咨询;
NMPA 体外诊断试剂注册咨询;
NMPA 进口I、II、III类医疗器械注册咨询;
NMPA I类医疗器械备案办理咨询;
医疗器械优先审批办理咨询
创新医疗器械审批申请服务
欧盟CE(MDD、IVDD、PPE、AIMDD);
美国FDA(列名、510K、PMA);
全球注册(加拿大、澳大利亚、日本等)
体系建立\内审\运行\考核服务;
医疗器械临床试验服务;
注册、体系、临床培训服务;